Il diamante e la grafite sono formati da soli atomi di carbonio...ma cosa li rende così diversi??
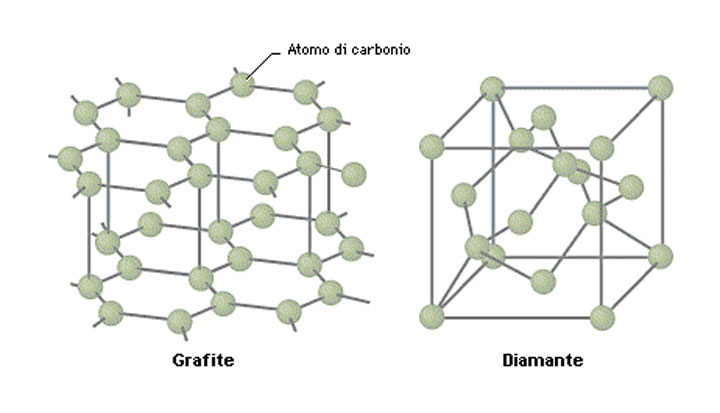
In un diamante, ogni atomo è connesso ad altri 4
atomi di carbonio e tutti insieme sono disposti in
modo tetraedrico. Si tratta di una struttura
tridimensionale estremamente forte e rigida che ci spiega il perchè della straordinaria durezza di questa gemma preziosa. Sappiamo infatti che il diamante sintetico è sfruttato per diversi utilizzi nell'industria
per il taglio di altri materiali. A causa della sua
struttura tetraedrica, il diamante mostra anche una
grande resistenza alla compressione. La durezza dei cristalli viene misurata grazie alla scala di Friederich Mohs che classifica i composti in base alla loro capacità di graffiarsi l’un l’altro. Il diamante
è il materiale più duro ad oggi conosciuto ed infatti viene indicato con valore di 10 sulla scala di Mohs.
La grafite, invece, adotta una struttura costituita da strati planari di atomi di carbonio formati da un reticolo a maglie esagonali. Gli atomi di carbonio sono disposti a strati proprio come una millefoglie e questi scorrono gli uni sugli altri e conferiscono alla grafite le sue caratteristiche di scivolosità al tatto. La durezza della grafite è ovviamente molto minore rispetto a quella del diamante e si aggira intorno a 1-1,5 sulla scala di Mohs.
Diamante:
 |
| foto: stuttura Grafite e diamante |
La grafite, invece, adotta una struttura costituita da strati planari di atomi di carbonio formati da un reticolo a maglie esagonali. Gli atomi di carbonio sono disposti a strati proprio come una millefoglie e questi scorrono gli uni sugli altri e conferiscono alla grafite le sue caratteristiche di scivolosità al tatto. La durezza della grafite è ovviamente molto minore rispetto a quella del diamante e si aggira intorno a 1-1,5 sulla scala di Mohs.
Diamante:
Densità: 3,51 g/cm³
Formula chimica: C
Parametri di cella: a = 35,67
Gruppo cristallino: Monometrico
Durezza (Mohs): 10
Colore: incolore, giallastro allocromatico
Grafite:
Densità: 2.09–2.23 g/cm³
Parametri di cella: a = 2.464, c = 6.736
Formula chimica: C
Sistema cristallino: esagonale compatto
Durezza (Mohs): 1-1,5
Colore: grigio
Le due strutture però non sono entrambe stabili allo stesso modo, la grafite posside la forma più stabile nella quale il carbonio tende spontaneamente ad organizzarsi e il diamante (metastabile) tende ad assumere la struttura tipica della grafite. Ebbene si, i diamanti tendono a diventare grafite per avere maggior stabilità, ma state tranquilli se ne possedete uno, la trasformazione è cineticamente talmente lenta che non avviene ad una velocità misurabile e quindi non vi troverete un pezzo di grafite sul vostro anello tanto facilmente. Fonti: WikipediaMineralogia di Cornelis Klein
Densità: 3,51 g/cm³
Formula chimica: C
Parametri di cella: a = 35,67
Gruppo cristallino: Monometrico
Durezza (Mohs): 10
Colore: incolore, giallastro allocromatico
Grafite:
Grafite:
Densità: 2.09–2.23 g/cm³
Parametri di cella: a = 2.464, c = 6.736
Formula chimica: C
Sistema cristallino: esagonale compatto
Durezza (Mohs): 1-1,5
Colore: grigio
Le due strutture però non sono entrambe stabili allo stesso modo, la grafite posside la forma più stabile nella quale il carbonio tende spontaneamente ad organizzarsi e il diamante (metastabile) tende ad assumere la struttura tipica della grafite. Ebbene si, i diamanti tendono a diventare grafite per avere maggior stabilità, ma state tranquilli se ne possedete uno, la trasformazione è cineticamente talmente lenta che non avviene ad una velocità misurabile e quindi non vi troverete un pezzo di grafite sul vostro anello tanto facilmente.
Le due strutture però non sono entrambe stabili allo stesso modo, la grafite posside la forma più stabile nella quale il carbonio tende spontaneamente ad organizzarsi e il diamante (metastabile) tende ad assumere la struttura tipica della grafite. Ebbene si, i diamanti tendono a diventare grafite per avere maggior stabilità, ma state tranquilli se ne possedete uno, la trasformazione è cineticamente talmente lenta che non avviene ad una velocità misurabile e quindi non vi troverete un pezzo di grafite sul vostro anello tanto facilmente.
Fonti:
Wikipedia
Mineralogia di Cornelis Klein
Commenti
Posta un commento